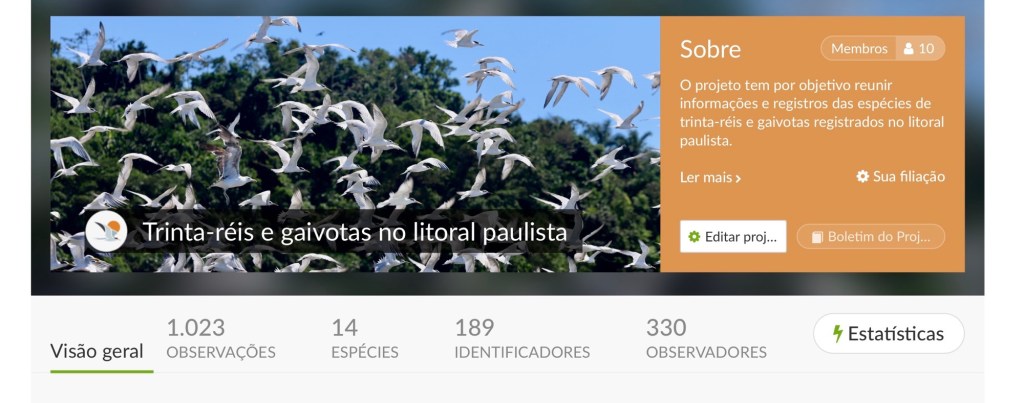
A família Laridae reúne algumas das aves mais conhecidas do ambiente costeiro: as gaivotas e os trinta-réis. Composta por cinco subfamílias, todas representadas no Brasil, destaca-se especialmente pelas subfamílias Larinae (gaivotas) e Sterninae (trinta-réis), que são as mais diversas em número de espécies. Segundo Pacheco et al. (2021), o país abriga dez espécies de gaivotas e quinze de trinta-réis.
As gaivotas, amplamente distribuídas pelo planeta, são aves costeiras reconhecidas por sua grande capacidade de adaptação e comportamento oportunista (Branco, 2001; Winkler et al., 2020). No litoral do estado de São Paulo, seis espécies são encontradas, entre elas o imponente gaivotão (Larus dominicanus), facilmente observado na região.

Gaivotão
Larus dominicanus
Razoavelmente comum ao longo da costa de São Paulo e do Rio de Janeiro, em menor número até o Espírito Santo; mais a norte, errante. No adulto, bico robusto amarelo com pinta vermelha na mandíbula, olho claro e pernas amareladas; jovem com bico escuro, olho escuro e pernas cinzentas. Adulto com o corpo branco e manto enegrecido. Maior que qualquer outra gaivota no Brasil (Ridgely et al. 2015).
Fotografia: Marcio C Motta (Parque Estadual Xixová-Japuí) – veja destalhes do registro no iNaturalist
Vocalização: (Xenocanto) Douglas Meyer, Imbituba (SC,BRA) – CC SA 4.0
É considerada a espécie de larídeo mais abundante e amplamente distribuída no Hemisfério Sul, reproduzindo-se em diversas regiões, incluindo África, Nova Zelândia, Austrália, ilhas subantárticas, Península Antártica e América do Sul (SICK, 1997; BURGER et al., 2024). Na América do Sul, ao longo da costa atlântica, sua reprodução ocorre preferencialmente em ilhas, desde a Terra do Fogo, na Argentina, até o estado do Rio de Janeiro, no Brasil, com presença registrada a partir do Rio Grande do Sul (NOVELLI, 1997; SICK, 1997).
Habita áreas predominantemente costeiras, incluindo águas litorâneas, mas também frequenta lagos interiores de grande porte, reservatórios, estuários, rios, além de gramados e áreas agrícolas (BURGER & GOCHFELD, 2024). Morfologicamente, apresenta comprimento entre 540 e 650 milímetros, peso variando de 810 a 1335 gramas e envergadura entre 128 e 142 centímetros. Possui partes superiores de coloração preta intensa e pernas de tonalidade amarelo-esverdeada pálida, características que a tornam facilmente distinguível de outras gaivotas em sua área de distribuição (BURGER et al., 2024). Trata-se de uma espécie generalista, com comportamento oportunista, adaptando-se a diferentes estratégias de forrageamento e consumindo uma ampla variedade de presas e itens alimentares (BRANCO, 2001; SILVA-COSTA & BUGONI, 2013).
Além disso, L. dominicanus explora fontes antrópicas de alimento, como resíduos descartados por atividades humanas, sendo frequentemente observada em lixões e áreas de descarte de resíduos urbanos (YORIO et al., 1998; SILVA RODRÍGUEZ et al., 2000; YORIO & GIACCARDI, 2002; BRANCO et al., 2009).
Trinta-réis
Os trinta-réis são aves aquáticas coloniais de pequeno porte, que habitam ambientes marinhos e de água doce, especialmente em zonas costeiras e estuarinas de climas tropicais e temperados (Gochfeld & Burger, 1996; Bridge et al., 2005; Cabot & Nisbet, 2013). Das quinze espécies registradas no Brasil, dez estão presentes no estado de São Paulo (Silveira & Uezu, 2011). No entanto, apenas três se reproduzem no litoral paulista, e duas dessas são frequentemente vistas na costa central do estado (Olmos et al., 1995; Campos et al., 2007; Casadei, 2017; Fundação Florestal, 2019).
A rica diversidade dessas aves e sua presença no litoral brasileiro reforçam a importância de estudos e ações de conservação para proteger seus habitats e garantir sua permanência nas paisagens costeiras do país.

Trinta-réis-real
Thalasseus maximus
Razoavelmente comum, de ocorrência localizada ao longo da costa, sobretudo em São Paulo e no Rio de Janeiro, em baías, estuários e lagoas costeiras, às vezes alimentando-se em mar aberto. Reprodução conhecida apenas em algumas ilhas de São Paulo. Bico forte, laranja- avermelhado ou laranja; pernas pretas (Ridgely et al. 2015).
Fotografia: Marcio C Motta (Parque Estadual Xixová-Japuí) – veja detalhes do registro no iNaturalist
Vocalização: (Xenocanto) Robson S. Silva, Cubatão (SP,BRA) – CC SA 4.0
O trinta-réis-real (Thalasseus maximus, Boddaert, 1783) caracteriza-se pelo seu grande porte, com comprimento que varia de 450 a 500 milímetros, envergadura de 125 a 135 centímetros e massa corporal de 350 a 450 gramas. A espécie não apresenta dimorfismo sexual, com um longo bico alaranjado e cauda moderadamente bifurcada (CABOT & NISBET, 2013; HARRISON, 2021; BUCKLEY et al., 2021). Anteriormente classificadas no gênero Sterna, as espécies de trinta-réis de crista, incluindo o trinta-réis-real, foram posteriormente realocadas para o gênero Thalasseus devido a suas características morfológicas, genéticas e comportamentais únicas (BUCKLEY et al., 2021).
As populações reprodutivas da espécie estão distribuídas por quatro principais regiões geográficas: a costa atlântica e do Golfo da América do Norte, o Mar do Caribe e o Golfo do México, a costa do Pacífico do México e o sudeste da América do Sul (ESCALANTE, 1985, 1973; YORIO et al., 2005; YORIO & EFE, 2008; BUCKLEY et al., 2021). Buckley et al. (2021) considera que a espécie possui duas principais populações reprodutivas: a população Boreal, que se reproduz nos Estados Unidos, incluindo as costas do Atlântico e do Golfo, a costa do Pacífico no sul da Califórnia e Baja Califórnia, ilhotas no México e partes do Caribe; e a população Austral, que se reproduz na Argentina, no Brasil e no Uruguai . Recentemente a população que ocorre na África é considerada outra espécie – T. albididorsalis (COLLINSON et al., 2021).
Em geral, colônias reprodutivas escolhem áreas insulares e isoladas, livres de predadores terrestres, embora em algumas localidades estruturas artificiais tornaram-se fundamentais para a conservação da espécie (BUCKLEY et al., 2021). Possui colônias de reprodução densamente povoadas e estratégias prolongadas de cuidado parental, formando creches (berçários comuns para filhotes antes da fase de voo) e exibem comportamentos altamente sociais e vocais, tornando-se conspícuas onde quer que estejam (ESCALANTE, 1968; SICK, 1997; CABOT & NISBET,2013).

Trinta-réis-de-bando
Thalasseus acuflavidus
Comum, de ocorrência localizada, por toda a costa, em esturários, lagoas costeiras e baías, nidificando em ilhas, às vezes em grandes colônias. Bico amarelo longo e esquio; pernas pretas (Ridgely et al. 2015).
Fotografia: Marcio C Motta (Parque Estadual Xixová-Japuí) – veja detalhes do registro no iNaturalist
Vocalização: (Xenocanto) Caio Brito, Linhares (ES,BRA) – CC SA 4.0
O trinta-réis-de-bando (Thalasseus acuflavidus Saunders, 1876), ocorre predominantemente ao longo das regiões costeiras e ilhas oceânicas. Durante a temporada reprodutiva, destaca-se por seu comportamento altamente gregário e colonial, formando densas colônias (SHEALER et al., 2020).
Ovos e filhotes em geral são brancos e cobertos por manchas. Após as primeiras semanas de nascimento, assim como T. maximus, se agrupam em creches nas regiões periféricas dos ninhais, onde são protegidos pelos adultos (NISBET & CABOT, 2013; EFE, 2004). Em média, os adultos da população que ocorre no Brasil possuem massa corporal de 234 gramas e envergadura de 30,5 centímetros (EFE et al.,2004). Apresentam grande variação da coloração do cúlmen e tarso. Quanto ao cúlmen, observa-se que pode variar de amarelo ao preto, com diversos graus intermediários (EFE, 2004). Gochfeld & Burger (1996), com bases em análises morfológicas, deslocaram a espécie do gênero Sterna para Thalasseus.
Efe et al. (2000) apontou o desafio da caracterização taxonômica e através de análises filogenéticas propôs que a população existe na Europa (T. sandvicensis sandvicensis) não era monofilética em relação aos da América (T. s. acuflavidus e T. s. eurygnathus) e deveriam ser consideradas espécies separadas. Assim, foi recomendado que as populações fossem divididas em T. sandvicensis e T. acuflavidus (EFE et al., 2009).
Sendo assim, considera-se no Brasil este arranjo taxonômico, conforme publicado por Pacheco et al. (2021) e presente na Lista Mundial de Aves, publicada pelo Comitê Ornitológico Internacional (GILL et al., 2024), embora não seja reconhecida pela Sociedade Ornitológica Americana (CHESSER et al., 2024). Essa população distribui-se do mar do Caribe à Costa Atlântica da América do Sul, desde a Venezuela até o sul da Argentina (ESCALANTE, 1970; GOCHFELD & BURGER, 1996; EFE et al., 2000). Contudo, há registro de intercruzamentos entre as populações do Norte e Sul (HAYES, 2004) e contato entre as populações da América do Norte e Brasil (SHEALER, 1999; EFE et al., 2000).

Trinta-réis-de-bico-vermelho
Sterna hirundinacea
Tais aves chegam a atingir 41 cm de comprimento e os adultos possuem bico e pés vermelhos o ano todo. O corpo é cinzento claro na parte superior e branco na parte ventral. Em plumagem reprodutivo tem fronte, píleo e nuca pretos, mas em plumagem não reprodutiva só tem preta a nuca com a fronte e píleo brancos. Os jovens tem bico preto ou cor intermédio, enquanto as asas e costas tem manchas cinza escuro (Wikiaves, 2024).
Fotografia: Marcio C Motta (Ilhote da prainha, Ilhabela) – veja detalhes do registro no iNaturalist
Vocalização: https://xeno-canto.org/species/Sterna-hirundinacea
O trinta-réis-do-bico-vermelho (Sterna hirundinacea) caracteriza-se pelo píleo preto, dorso cinza-pálido e partes inferiores em tom acinzentado mais claro, contrastando com as faces e coberteiras inferiores da cauda brancas; apresenta bico e pernas totalmente vermelhos. Assemelha-se morfologicamente a Sterna hirundo, porém é de maior porte, comparável a Thalasseus acuflavidus, distinguindo-se pelo bico mais robusto, cauda mais longa e partes inferiores mais escuras. Em plumagem não reprodutiva, os adultos apresentam testa e fronte brancas, enquanto os juvenis exibem píleo esbranquiçado-cremoso com manchas escuras, barrado dorsal e primárias cinza-escuras. Distribui-se do centro-sul do Peru (Ica) e centro-leste do Brasil (Espírito Santo) até a Terra do Fogo, incluindo as Ilhas Malvinas, expandindo-se no inverno austral até o Equador e Bahia.
É espécie costeira, nidificando em praias arenosas ou rochosas, falésias e pequenas ilhas, com registros de reprodução em corpos d’água interiores no Chile e nas Malvinas. Após a reprodução, desloca-se majoritariamente para o norte, sendo comum no Uruguai, Argentina (Chubut) e litoral do Rio Grande do Sul, alcançando até o Equador e a Bahia no inverno. Sua dieta é composta principalmente por peixes pequenos, notadamente Engraulis anchoita, além de Odonthestes incisa, O. argentinensis e Cynoscion guatucupa, além de crustáceos e insetos, forrageando preferencialmente por mergulho em voo (plunge-diving), muitas vezes associado a cardumes e cetáceos (GOCHFELD & BURGER, 2024).
Conservação das três espécies de trinta-réis
Com relação ao status de conservação, as três espécies estão classificadas como “Pouco Preocupante” globalmente (BIRDLIFE, 2018b; BIRDLIFE, 2019), embora constem nas listas de espécies ameaçadas de extinção (categorias EM para T. maximus e VU, para T. acuflavidus e S. hirundinacea) do estado (SÃO PAULO, 2018), e T. maximus, do Brasil, inserida na categoria “Em Perigo” (EN). O Ministério do Meio Ambiente (MMA, 2018) aconselha a realização de censos contínuos nas áreas de ocorrência no Brasil, com o objetivo de identificar mudanças na distribuição e abundância, além de conduzir estudos demográficos de longo prazo nas colônias de São Paulo, inclusive fora da área de reprodução (SILVA et al. 2005). O Plano de Ação Nacional para Aves Marinhas, que está sendo atualizado no presente, indica em um dos objetivos de ação “Caracterizar e monitorar as áreas de descanso das espécies na costa brasileira”.
Um estudo publicado por FARIA et al. (2007), demonstrou a baixa diferenciação genética de Thalasseus maximus, indicando limitada variabilidade entre as populações, o que pode comprometer sua capacidade adaptativa e aumentar sua vulnerabilidade à extinção. Esse cenário reforça a necessidade de estratégias de conservação que protejam habitats críticos e promovam a manutenção da diversidade genética remanescente. As duas espécies de trinta-réis sofrem pressão semelhantes na região e as principais ameaças estão relacionadas à ocupação humana da costa e áreas insulares, pesca e coleta de ovos (ESCALANTE, 1985; ANTAS, 1990; YORIO & QUINTANA, 1997; QUINTANA & YORIO, 1999; EFE et al., 2000; YORIO et al., 2001; BARBIERI et al. 2001; BARBIERI & PINNA, 2007; BARBIERI & PAES, 2008; YORIO & EFE, 2008; EFE & BONATTO, 2011; MINISTÉRIO DO MEIO AMBIENTE, 2018).
Neste sentido, a intensificação da urbanização e o consequente aumento das atividades recreativas humanas em ecossistemas naturais têm gerado perturbações significativas sobre as populações de aves costeiras, que desempenham um papel ecológico fundamental, atuando como bioindicadores da saúde de ecossistemas litorâneos (BURGER & GOCHFELD, 2004; OGDEN et al., 2014), participando de processos como a ciclagem de nutrientes (MICHELLUTI et al., 2009) e controle de populações de invertebrados (HORN et al., 2020). No entanto, essas espécies enfrentam pressões crescentes devido à expansão urbana (MARZLUFF, 2001), turismo desordenado (HAMZA, 2020) e introdução de espécies exóticas (ANTON et al., 2019), fatores que comprometem sua reprodução, alimentação e sobrevivência. Dentre os fatores antropogênicos que mais influenciam essas dinâmicas, destaca-se a presença de cães — sejam eles domiciliados, errantes ou acompanhando humanos — cujas interações podem alterar significativamente a distribuição espacial, os comportamentos antipredatórios e as taxas de sucesso reprodutivo das aves (HVENEGAARD & BARBIERI, 2010).
Referências:
- Ab’Saber, A. N. 2000. Fundamentos da geomorfologia costeira do Brasil atlântico inter e subtropical. Revista Brasileira de Geomorfologia, Rio de Janeiro, 1(1), 27–43.
- Andreu, C. T. 2019. Avifauna aquática do complexo estuarino de Santos-Cubatão: diversidade, riqueza, composição e status de conservação (Dissertation). Universidade Estadual Paulista. Retrieved from http://hdl.handle.net/11449/183641
- Banks, P. B. & Bryant, J. V. 2007. Four-legged friend or foe? Dog walking displaces native birds from natural areas. Biology Letters v, 3(6), 611–613.
- Barbieri, E. & Delchiaro, R. T. S. 2017. Influence of tide on composition of the bird fauna in Ilha Comprida,São Paulo, Brazil. Pan-American Journal of Aquatic Sciences, 12(2), 166–171.
- Barbieri, E. & Mendonça, J. T. 2008. Seasonal abundance and distribution of Larids at Ilha Comprida (São Paulo State, Brazil. Journal of Coastal Research v, 24(1), 70–78.
- Barbieri, E. 2008. The gull (Larus dominicanus) distribution during the year of the 2005 at Cananéia-Iguape-Ilha Comprida estuary, São Paulo, Brazil. Biota Neotropica, v. 8, p. 000-000, 2008.
- Barbieri, E. & Paes, E. T. 2008. The birds at Ilha Comprida beach (São Paulo State, Brazil): a multivariate approach. Biota Neotropica, 8(3), 41–50.
- Barbieri, E. & Pinna, F. V. 2007a. Distribuição do trinta-réis-real (Thalasseus maximus) durante 2005 no estuário de Cananéia-Iguape-Ilha Comprida. Ornithologia Neotropical, 18, 99–110.
- Barbieri, E. & Pinna, F. V. 2007b. Variação sazonal do trinta-réis-de-bando (Thalasseus sandvicensis eurygnatha) durante 2005 no estuário de Cananéia-Iguape-Ilha Comprida. Ornithologia Neotropical, 18, 563–572.
- Bibby, C. J., Burgess, N. D. & Hill, D. A. 1992. Bird census techniques (1st ed.). London: Academic Press.
- Birdlife International. 2018a. Larus dominicanus. The IUCN Red List of Threatened Species. DOI: https://doi.org/10.2305/IUCN.UK.20182.RLTS.T22694329A132542863.en.
- Birdlife International. 2018b. Thalasseus maximus. The IUCN Red List of Threatened Species. DOI: https://doi.org/10.2305/IUCN.UK.2018-2.RLTS.T22694542A132559155.en
- Birdlife International. 2019. Thalasseus sandvicensis. The IUCN Red List of Threatened Species. DOI: https://doi.org/10.2305/IUCN.UK.2019-3.RLTS.T22694591A154517364.en
- Blus, L. J., Prouty, R. M. & Neely JR, B. S. 1979. Relation of environmental factors to breeding status of Royal and Sandwich terns in South. Biological Conservation, 16, 301–320.
- Branco, J. O. 2001. Descartes da pesca do camarão sete-barbas como fonte de alimento para aves marinhas. Revista Brasileira de Zoologia, 18, 293–300.
- Branco, J. O. 2004. Aves marinhas das Ilhas de Santa Catarina. In: Aves marinhas e insulares brasileiras: bioecologia e conservação (pp. 15–36). Itajaí, UNIVALI.
- Branco, J. O. 2007. Avifauna aquática do Saco da Fazenda (Itajaí, Santa Catarina, Brasil): uma década de monitoramento. Revista Brasileirade Zoologia, 24(4), 873–882.
- Branco, J. O., Barbieri, E. & Fracasso, H. A. 2010. Técnicas de pesquisa em aves marinhas. In: Ornitologia e Conservação. Ciência Aplicada, Técnicas de Pesquisa e Levantamento (pp. 217–236). Rio de Janeiro: Technical Books Editora.
- Bridge, E. S., Jones, A. W. & Baker, J. A. 2005. A phylogenetic framework for the terns (Sternini) inferred from mtDNA sequences: implications for taxonomy and plumage evolution. Molecular Phylogenetics and Evolution, 35, 459–469.
- Brusius, B. K., Buss de Souza, R, Pereira de Freitas, R., Barbieri, E. 2021. Effects of environmental variables on Magellanic penguin (Spheniscus magellanicus) strandings in southeastern Brazil. Ocean & Coastal Management, v. 210, p. 105704.
- Bugoni, L. & Vooren, C. M. 1996. Distribution and Abundance of Six Tern Species in Southern Brazil Daily Budget Activities of Common Tern. Waterbirds, 28(1), 110–119.
- Burger, J., Carlucci, S. A., Jeitner, C. W. & Niles, L. 2007. Habitat choice, disturbance, and management of foraging shorebirds and gulls at a migratory stopover. Journal of Coastal Research, 23(5), 1159–1166.
- Burger, J. & Gochfeld, M. 1991. Human Distance and Birds: Tolerance and Response Distances of Resident and Migrant Species in India. Environmental Conservation, 18(2), 158–166.
- Burger, J., Howe, M. A., Hahn, D. C. & Chase, J. 1977. Effects of tide cycles on Habitat selection and habitat partitioning by migrating shorebirds. The Auk, 94(6), 743–758.
- Cabot, D. & Nisbet, I. 2013. Terns. London: Harper Collins.
- Cabral, S. A. S., Azevedo Jr., S. M. & Larrazabal, M. E. 2006. Abundância sazonal de aves migratórias na Área de Proteção Ambiental de Piaçabuçu, Alagoas, Brasil. Revista Brasileira de Zoologia, 23(3), 865–869.
- Campos, F. P., Paludo, D., Faria, P. J. & Martuscelli, P. 2004. Aves insulares marinhas, residentes e migratórias, do litoral do Estado de São Paulo. In: Branco, J. O. (ed.), Aves marinhas insulares brasileiras: bioecologia e conservação. (pp. 57–82). Itajaí: Editora da UNIVALI.
- Casadei, L. O. 2017. Riqueza de aves do Portinho (Parque Ezio Dall’Áqua) município de Praia Grande, litoral sul do Estado de São Paulo. (Dissertation). Universidade Santa Cecília, Santos, 82 pp. Retrieved from http://unisanta.br/Download/Download?NomeDoArquivoOriginal=mestrado\ecologia\dissertacoes\Dissertacao_Leonardo.pdf
- Cestari, C. 2008. O uso de praias arenosas com diferentes concentrações humanas por espécies de aves limícolas (Charadriidae e Scolopacidae) neárticas no sudeste do Brasil. Biota Neotropica, 8(4), 83–88.
- Costa, L., Rangel, D. F. & Zalmon, I. 2023. Effect of touristic activities on seabirds’ habitat selection on sandy beaches.International Journal of Oceanography and Hydrobiology, 52(3), 287–298.
- Costa, V. T. 2014. Ocorrência e sazonalidade de espécies de trinta-réis na praia de Paranapuã – Parque Estadual Xixová-Japuí (Conclusão de Graduação). Unesp, Campus Litoral Paulista, 26 pp. Retrieved from https://unesp.primo.exlibrisgroup.com/permalink/55UNESP_INST/niq1ua/alma990008437390206341
- Diniz, C. G., Magalhães, N. G., Diniz, D. G., Pereira, P. D., Paulo, D. C., Rendeiro, F. R., Sherry, D. F. & Diniz, C. W. P. 2016. Cães domésticos como predadores de ninhos de batuíra bicuda (Charadrius wilsonia) no nordeste do Brasil. Revista da Biologia, 16(1), 24–27.
- Dubowy, P. J. 1996. Effects of water levels and weather on wintering herons and Egrets. The Southwestern Naturalist, 41(4), 341–7.
- Ebert, lA, Branco, J. O. & Barbieri, E. 2014. Daily Activities of Larus dominicanus (Lichtenstein1823) at Saco da Fazenda, Itajaí-Açú river estuary, Itajaí, SC. Pan-American Journal ofAquatic Sciences, 9(2), 199–206.
- Efe, M. A. & Bonatto, S. L. 2011. Evaluation of the status of conservation of the Cabot’s Tern (Thalasseus acuflavidus) in Brazil. Revista Brasileira de Ornitologia, São Paulo, 19(3), 358–363.
- Efe, M. A., Nascimento, J. L. X., Nascimento, I. de L. S. & Musso, C. 2000. Distribuição e Ecologia Reprodutiva de Sterna sandvicensis eurygnatha no Brasil. Melopsittacus, 3(3), 110–121.
- Erwin, M. 1977. Foraging and Breeding Adaptations to Different Food Regimes in Three Seabirds: The Common Tern, Sterna hirundo, Royal Tern, Sterna maxima, and Black Skimmer, Rynchops niger. Ecology, 58(2), 389–397.
- Escalante, R. 1968. Notes on the Royal Tern in Uruguay. Condor, 70, 243–247.
- Esparza, K.A.Á., Lima, B. & Barbieri, E. 2025. Assessing the anthropogenic disturbance impact on migratory and resident shorebirds in sandy beaches of the São Paulo, Brazil Coast. Ornithol. Res. 33, 46. https://doi.org/10.1007/s43388-025-00251-2
- FF (Fundação Florestal). 2010. Plano de Manejo Parque Estadual Xixová-Japuí. Imprensa Oficial de São Paulo.
- FF (Fundação Florestal) & Imprensa Oficial de São Paulo. 2019. Plano de Manejo Área de Proteção Ambiental Marinha Litoral Centro de São Paulo.
- Fracasso, H. A. A., Branco, J. O., Barbieri, E. 2011. A comparison of foraging between the South American and Cabot’s Tern in southern Brazil. Biota Neotropica , v. 11, p. 189-196.
- Furness, R. W. & Monaghan, P. 1987. Seabird Ecology. Glasgow: Blackie & Son Limited.
- Gochfeld, M. & Burger, J. 1996. Family Sternidae (terns). In: Hoyo, D., Elliot, J., & Sargatal., A. (eds.), Handbook of the Birds of the World, Hoatzin to Auks (pp. 624–667). Barcelona: Lynx Edicions.
- Gochfeld, M., J. Burger, E. de Juana, E. Garcia, and V. Pantoja-Maggi (2024). South American Tern (Sterna hirundinacea), version 1.1. In Birds of the World (J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, E. de Juana, and F. Medrano, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.soater1.01.1
- Gómez-Serrano, M. Á. 2020. Four-legged foes: dogs disturb nesting plovers more than people do on tourist beaches. Ibis. DOI: https://doi.org/10.1111/ibi.12879
- Hammer, Ø., Harper, D. A. T. & Ryan, P. D. 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica, 4, 9.
- Harrison, P., Perrow, M. & Larsson, H. 2021. Seabirds: The New Identification Guide (1st ed.). Barcelona: Lynx Edicions.
- Hays, H., Lima, P., Monteiro, L., Diconstanzo, J. & Cormons, G. 1999. A nonbreeding concentration of roseate and common terns in Bahia, Brazil. Journal of Field Ornithology, 70, 455–464.
- Hvenegaard, G. T. & Barbieri, E. 2010. Shorebirds in the State of Sergipe, northeast Brazil: Potential Tourism Impacts. Revista Brasileira de Ornitologia, 18, 169–175.
- IBGE (Instituto Brasileiro de Geografia e Estatística). 2023. Censo Demográfico 2022: resultados gerais da população e dos domicílios.
- IF (Instituto Florestal). 2010. Inventário Florestal da Vegetação Natural do Estado de São Paulo 2008/2009.
- Klein, M. L. 1993. Waterbird Behavioral Responses to Human Disturbances. Wildlife Society Bulletin S.l, 21(1), 31–39.
- Lafferty, K. D. 2001. Birds at a Southern California beach: seasonality, habitat use and disturbance by human activity. Biodiversity and Conservation, 10, 1949–1962.
- Lafferty, K. D., Goodman, D. & Sandoval, C. P. 2006. Restoration of breeding by snowy plovers following protection from disturbance. Biodiversity and Conservation, 15(7), 2217–2230.
- Lamparelli, C. C., Moura, D. O., Lopes, C. F., Rodrigues, F., Milanelli, J. C. C. & Vincent, R. C. 1998. Mapeamento dos Ecossistemas costeiros do estado de São Paulo. São Paulo: CETESB, Secretaria de Estado e Meio Ambiente, Páginas e Letras.
- Lima, R. G. & Santos, J. A. P. 2023. Diversidade e abundância das aves costeiras das praias de Mongaguá, litoral do estado de São Paulo. UNISANTA Bioscience, 12(4), 298–303. Accessed: https://periodicos.unisanta.br/BIO/article/view/619
- Lisnizer, N., Cotichelli, L., Yorio, P., Basso, N. & Gatto, A. 2014. Using morphometry and molecular markers for sexing South American, Cayenne and Royal terns breeding in Patagonia, Argentina. Waterbirds, 37(2), 183–190. DOI: https://doi.org/10.1675/063.037.0207
- Meager, J. J., Schlacher, T. A. & Nielses, T. 2012. Humans alter habitat selection of birds on ocean-exposed sandy beaches. Diversity and Distributions S. l, 18, 294-306,.
- MMA (Ministério do Meio Ambiente). 2007. Priority areas for the conservation, sustainable use and benefit sharing of Brazilian biological diversity. Brasília: Ministério do Meio Ambiente.
- MMA (Ministério do Meio Ambiente). Reconhece a lista nacional oficial de fauna ameaçada de extinção, Pub. L. No. Portaria no 444, 121 (2014).
- MMA (Ministério do Meio Ambiente). 2018. Livro Vermelho da Fauna Brasileira Ameaçada de Extinção (1st ed.). Brasília: ICMBio/MMA, 712 pp.
- Neves, T. 1994. Ocorrência de atividade reprodutiva de Sterna maxima (Laridae Charadriiformes) no Parque Estadual Marinho da Laje de Santos, SP. In: Resumos XX Congresso Brasileiro de Zoologia. Rio de Janeiro.
- Noveli, R. 1997. Aves marinhas do Brasil. Identificação e biologia. Porto Alegre: Cinco Continentes Editora.
- Numao, F. H. & Barbieri, E. 2011. Variação sazonal de aves marinhas no baixio do Arrozal, município de Cananéia,São Paulo.O Mundo da Saúde. O Mundo da Saúde, 35, 71–83.
- Olmos, F. & Martuscelli, P. 2004. Répteis, aves e mamíferos marinhos do litoral sul de São Paulo. In: Estação Ecológica Jureia-Itatins. Ambiente físico, flora e fauna (pp. 331–356). Holos Editora.
- Olmos, F., Martuscelli, P. & Silva, R. S. 1995. The sea birds of São Paulo, southeastern Brazil. Bulletin of the British Ornithologists’ Club, 115(2), 117–128.
- Pacheco, J. F., Silveira, L. F. & Aleixo, A. 2021. Annotated checklist of the birds of Brazil by the Brazilian Ornithological Records Committee – second edition. Ornithology Research, 29(2). DOI: https://doi.org/10.1007/s43388-021-00058-x
- Praia Grande (Município). Código de Posturas do Município, Pub. L. No. Lei no 657 (1989).
- Quintana, F. & Yorio, P. 1999. Kleptoparasitism by Kelp Gulls on Royal and Cayenne terns at Punta Leon, Argentina. Journal of Field Ornithology, 70(3), 337–342.
- São Paulo (Estado). Cria o Parque Estadual Xixová-Japuí e dá providências correlatas, Pub. L. No. Decreto no 37.536, § 1, 1 (1993).
- São Paulo (Estado). Declara as espécies da fauna silvestre no Estado de São Paulo regionalmente extintas, as ameaçadas de extinção, as quase ameaçadas e as com dados insuficientes para avaliação, e dá providências correlatas, Pub. L. No. Decreto no 63.853, 1 (2018).
- São Vicente (Município). Acrescenta e altera dispositivos da Lei no 1899/82, que proíbe a permanência ou trânsito de animais nas praias do município e dá outras providências, Pub. L. No. Lei no 2447-A (2010).
- Scholaro, J. A., Laurenti, S. & Gallelli, H. 1996. The nesting and breeding biology of the South American Tern in northern Patagonia. Journal of Field Ornithology, 67, 17-24,.
- Shealer, D., Liechty, J. S., Pierce, A. R., Pyle, P. & Patten, M. A. 2020. Sandwich Tern (Thalasseus sandvicensis), version 1.0. In: Billerman, S. M. (ed.), Birds of the World. Ithaca, NY: Cornell Lab of Ornithology. DOI: https://doi.org/10.2173/bow.santer1.01
- Sick, H. 1997. Ornitologia Brasileira. Rio de Janeiro: Nova Fronteira.
- Silva, R. S. & Olmos, F. 2007. Adendas e registros significativos para a avifauna dos manguezais de Santos e Cubatão, SP. Revista Brasileira de Ornitologia, 15(4), 551–560.
- Silva-Costa, A. & Bugoni, L. 2013. Feeding ecology of Kelp Gulls (Larus dominicanus) in marine and limnetic environments. Aquatic Ecology, 47, 211–224.
- Silva-Rodriguez, E. A., Cortés, E. I., Zambrano, B., Naughton-Treves, L. & Farias, A. A. 2023. On the causes and consequences of the free-roaming dog problem in southern Chile. Science of the Total Environment. DOI: https://doi.org/10.1016/j.scitotenv.2023.164324
- Silveira, L. F. & Uezu, A. 2011. Checklist of birds from Sao Paulo State, Brazil. Biota Neotropica, 11(1), 85–110.
- Vooren, C. M. & Brusque, L. F. 1999. Diagnóstico Sobre Aves do Ambiente Costeiro do Brasil. In: Avaliação e Áreas Prioritárias para a Conservação da Biodiversidade da Zona Costeira e Marinha. Fundação Universidade Federal do Rio Grande. Accessed: http://www.bdt.org.br/workshop/costa/aves/CAP5
- Weston, M. A. & Stankowich, T. 2014. Dogs as agents of disturbance. In: Gompper, M. E. (ed.), Free-Ranging Dogs and Wildlife Conservation (pp. 94–109). Oxford: Oxford University Press.
- Yorio, P., Bertolotti, M. & Garcia-Borboroglu, P. 2005. Estado poblacional y de conservación de gaviotas que se reproducen en el litoral marítimo argentino. El Hornero, 20(1), 53–74.
- Yorio, P., Frere, E., Gandini, P. & Schiavini, A. 2001. Tourism and recreation at seabird breeding sites in Patagonia, Argentina: current concerns and future prospects. Bird Conservation International, 11, 231–245.
- Yorio, P. & Quintana, F. 1997. Predation by Kelp Gulls (Larus dominicanus) at a mixed-species colony of Royal Terns (Sterna maxima) and Cayenne Tern (Sterna eurygnatha) in Patagonia. Ibis, 139, 536-541,.
- Yorio, P., Quintana, F., Campagna, C. & Harris, C. 1994. Diversidad, abundancia y dinámica espacio-temporal de la colonia mixta de aves marinas en Punta Leon, Patagonia. Ornithologia Neotropical, 6, 69–77.
- Zanin, G. R., Tosin, L. F. & Barbieri, E. 2008. Influência da maré na abundância de Egreta caerulea (Linnaeus, 1758) em uma enseada estuarina na Ilha Comprida, São Paulo, Brasil. Estudos de Biologia, 30(1), 133–139.
- WINKLER, D. W.; BILLERMAN, S. M.; LOVETTE, I. J. Gulls, Terns, and Skimmers (Laridae), version 1.0. In: BILLERMAN, S. M.; KEENEY, B. K.; RODEWALD, P. G.; SCHULENBERG, T. S. (Eds.). Birds of the World. Ithaca, NY: Cornell Lab of Ornithology, 2020. Disponível em: https://doi.org/10.2173/bow.larida1.01
- Xenocanto (base de dados de cantos das aves): https://www.xeno-canto.org/ (licença Creative Commons SA 4.0)